 |
|
|
![]()
 Химические свойства воды
Химические свойства воды
![]()
Химические свойства воды
Для аквариумистов наибольший интерес представляют активная реакция воды и ее жесткость.
Активная реакция воды - рН . Нейтральная вода имеет рН 7,0 - это значит, что в воде находится равное количество кислоты и щелочи, или вовсе отсутствует и то и другое. Отклонение в ту или иную стороны свидетельствует о повышении кислотности или увеличении щелочности. Так, если нейтральный показатель повышен (т. с., больше 7) - это говорит о повышении щелочности, если показатель меньше 7 - о кислотности.
В пресноводном аквариуме рН варьирует от 4,5 до 9,0 (таковы параметры водопроводной воды). Большинство природных водоемов имеет рН 6,5 - 8,5, то есть их вода вполне пригодна для аквариума. Измерение рН проводят бумажными индикаторами или электронным рН-метром.
Жесткость воды имеет большое значение для существования рыб, она зависит от различного содержания окиси кальция в воде. Судить о степени жесткости или мягкости воды следует по ее мыльности: мягкая вода легко образует пену при взбитии, жесткая не пенится (в жесткой воде очень трудно вымыть руки с мылом или голову с шампунем - может не смыться) Сведения о жесткости воды можно узнать в санитарно-эпидемиологической станции или инспекции санитарно-ветеринарного надзора.
Жесткость воды делится, на общую (некарбонатную) и временную (карбонатную). В продаже имеются различные градусники жесткости. Общая жесткость обозначается dH, а временная КН. Один градус жесткости говорит о том, что в 1 л воды содержится 10 мг СаО.
В России за единицу жесткости воды принят миллимоль/литр, иными словами, 1 ммоль/л равен 20,04 мг кальция или 12,16 мг магния. Однако аквариумисты чаще пользуются немецкими градусами жесткости — dGH (deufsche Gesamt Harte), где общая жесткость обозначается — GH (Gesamt Harte), а временная — КН (Karbonat Harte).
Для приведения к единому знаменателю укажем, что 1 мг-экв/л равен 2,8 немецкого градуса, 3,5 английского и 5 французским.
Таблица жесткости воды (в немецких градусах):
Очень мягкая вода от 0 до 4° (бидистиллят и химически обессоленная 0 - 0,4°)
Мягкая от 5 до 10°
Средней жесткости от 11 до 18°
Жесткая от 19 до 30°
Очень жесткая свыше 30°
Наиболее благоприятно соотношение временной и общей жесткости 1 : 2. Для аквариума спектр жесткости воды варьирует от 3 до 10°, то есть она должна быть очень мягкая или мягкая.
Гидрохимический состав
Подземные, речные, водопроводные воды имеют весьма сложный химический состав. С водой в чистом виде мы встречаемся только в лабораторных условиях. Существующее мнение о “чистой” дождевой воде лишено всякого основания: в ней всегда есть хлор, натрий, сульфат, кальций, аммоний. Количество веществ в дождевой воде в зависимости от концентрации промышленных выбросов в воздух колеблется от 0,8 до 489 мг/л. Бессмысленно пока говорить о “чистоте” водопроводной воды. В зависимости от концентрации промышленных предприятий речные и озерные воды имеют немало “лишних” веществ, несмотря на очистку воды, на водопроводных станциях.
В воде водоемов происходят многие биологические процессы, меняющие химический состав воды и насыщающие воду органическими веществами. Совокупность всех этих веществ определяет и химический состав воды в аквариуме. Но в разных регионах страны он будет, естественно, неодинаков.
Аквариумная вода содержит различные вещества в ионной и молекулярной форме.
Основной солевой состав приходится, на семь ионов: кальция, магния, натрия, калия, хлоридов, гидрокарбонатов и сульфатов. Кроме того, в воде в большей или меньшей степени содержатся медь, марганец, железо, фтор, йод, бор, цинк и другие элементы. Степень минерализации разных вод также различна, но обычно не превышает грамм, на литр (в морской воде она значительно выше). Для понимания биологической роли всех этих компонентов важно знать, в какой форме они находятся в воде и какие химические реакции в ней происходят.
Рассмотрим отдельные биогенные элементы, их содержание в воде и значение для растительных организмов.
Азот входит в состав всех белковых молекул и аминокислот. Содержание азота в среднем составляет 3%. Животные получают азот из животной или растительной пищи, а растения — в виде неорганических соединений, главным образом, нитратов (NO 3- ) и аммония (NH 4+ ). Свободный азот из атмосферы недоступен водным растениям. Недостаток азота ведет к снижению содержания хлорофилла в листьях, в первую очередь в старых, к уменьшению размеров растения. В аквариуме, населенном рыбами, азотное голодание растений практически не встречается. Чаще наблюдается избыток азотных соединений.
На следующем месте после азота по потреблению стоит фосфор. Его содержание в растениях составляет около 0,23%. фосфор входит в состав макроэнергетических соединений живого организма, например АТФ и АДФ, Фосфатные связи этих соединений позволяют накапливать энергию, запасать ее и использовать для образования сложных органических молекул, транспорта молекул и переноса энергии в клетке,
Основным источником фосфора для растений служат фосфаты. Наибольшее количество фосфатов находится в виде дигидрофосфат - ионов Н 2PO4- . Некоторое количество фосфатов содержится также в виде ионов НРО 42- и РО 43- . Количественные соотношения этих ионов тесно связаны с кислотностью воды. Абсолютное содержание фосфора в водопроводной и природной воде составляет от 1 до 100 мкг/л. В аквариум фосфор попадает со свежей водой и кормом для рыб. Остатки органических веществ поступают в грунт, где преобразуются в неорганические фосфат - ионы и в таком виде усваиваются растениями. При недостатке фосфора в листьях накапливается красный пигмент антоциан, листья мельчают, и становятся уже.
Значение биогенного элемента калия для растения многообразно. Он способствует нормальному протеканию фотосинтеза, участвует в образовании питательных веществ. Приблизительное содержание калия в растениях составляет 1,4%. Основная масса его находится в виде ионов К + , которые легко перемещаются через клеточные мембраны. Больше всего ионов калия содержится в листьях растений. Недостаток этого элемента нарушает азотный обмен и приводит к отмиранию тканей.
Сера входит в состав некоторых аминокислот, которые в свою очередь являются составными частями белков. Кроме того, сера содержится в веществах, необходимых для осуществления различных окислительно-восстановительных реакций в процессе фотосинтеза, Содержание серы составляет приблизительно 0,35%. Она потребляется растениями главным образом в виде сульфат - ионов SO 42- При недостатке этого элемента задерживается рост и размножение растения.
Содержание кальция в растении составляет 1,8%, Он входит в состав клеточных стенок в виде мало растворимых солей. Кальций играет важную роль в избирательной проницаемости клеточных мембран. Недостаток этого элемента приводит к недостаточной “плотности” мембран с точки зрения диффузии через них различных веществ. Если молодым растениям не хватает кальция, то они бледнеют и приобретают неправильную форму. В аквариумных условиях обычно недостатка кальция не наблюдается, г. к. он всегда содержится в водопроводной воде в достаточном количестве.
Большое значение в жизни растений имеет магний. Он входит в состав молекул хлорофилла. Содержание магния в растениях составляет 0,32%. При недостатке этого элемента листья желтеют от дефицита хлорофилла. Недостаток магния может создаваться при относительно высоком содержании кальция вследствие антагонизма между ионами Са 2+ и Мg 2+ . Во многих районах средней полосы нашей страны содержание магния в природной воде невелико, и оно быстро убывает при развитии растительности. Поэтому многим аквариумистам приходится вносить этот элемент в аквариумную воду.
Содержание хлора в растениях составляет 0,2%. В виде хлорид—анионов Сl - он участвует в регуляции внутриклеточного давления. У некоторых растений содержание хлора невелико, его роль выполняют органические ионы, и он не является необходимым элементом. В некоторых случаях хлор стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием и выделением энергии (однако точно его роль в этих процессах еще не определена). В природных водах всегда содержится достаточное для растений количество хлорид—ионов.
Содержание натрия в растениях составляет 0,12%. Несмотря на высокое содержание, его роль в жизни растения изучена недостаточно. Известно, что натрий способствует созданию высокого осмотического давления в клетках и является антагонистом калия. В воде этот элемент всегда присутствует в достаточных количествах в виде катионов натрия Na+.
Следующая группа питательных веществ — микроэлементы. Они входят в состав различных ферментов и принимают участие в биохимических реакциях.
Железо содержится во всех растениях (массовая доля составляет 0,014%). Оно входит в состав многих важных растительных ферментов, участвующих в окислительно—восстановительных реакциях, где используется способность железа резко переходить из двух в трехвалентное состояние и обратно:
Fe3+ + e- = Fe2+
Эти ферменты участвуют в синтезе хлорофилла. При недостатке железа синтез хлорофилла затруднен, а при сильном недостатке листья могут стать белыми. Заболевание, вызванное недостатком железа, носит название хлороза. Аквариумные растения часто страдают от этой болезни, т. к. в воде, богатой фосфатами, железо быстро выпадает в осадок. Обеспечение нормального питания железом — одна из наиболее важных задач при культивации водных растений.
Мы в течение ряда лет при культивации аквариумных растений используем различные минеральные подкормки, в том числе соединения железа. Наиболее эффективно применение комплексных соединений железа (II) с органическими комплексообразующими агентами, например, этилендиаминтетрауксусной кислотой (ЭДТА). Химический анализ воды в аквариуме показывает, что особенно интенсивное поглощение комплексных соединений железа происходит впервые 12 ч после введения добавки. Затем, в течение трех суток, концентрация железа в воде постепенно снижается и становится приблизительно в 5 - 10 раз меньше исходной (сразу после введения добавки). Поэтому необходимо регулярно, не реже двух раз в неделю, подкармливать аквариумные растения железосодержащими препаратами.
Содержание меди в растении составляет 0,0015%. Медь служит составной частью некоторых окислительных ферментов и белков, таким образом, способствуя росту и развитию растений. По нашим данным, медь довольно активно поглощается из воды аквариумными растениями: после внесения добавки, содержащей микроколичества сульфата меди (II), в течение 12 - 20 часов концентрация этого элемента в воде падает практически до нуля (анализ проводился с использованием высокоточных инструментальных методов).
Цинк — один из важных биогенных элементов, постоянно присутствует в тканях растений и животных. Его содержание в большинстве организмов составляет 0,01%. Он входит в состав фермента карбоангидразы, который служит катализатором гидратации СО2 . Цинк участвует в синтезе растительного гормона — индолилуксусной кислоты, выполняет существенную роль в синтезе молекул РНК, регулирует рост растений, влияет на образование некоторых аминокислот, повышает содержание растительных гормонов—гиббереллинов, влияет на развитие яйцеклеток и зародышей. При отсутствии цинка растения остаются недоразвитыми.
Бора содержится в растениях в среднем 0,005%. Он необходим для их нормального развития. Недостаток бора приводит к гибели ростовых (меристемных) клеток и к отмиранию ростовых почек. Черешки и листья при этом становятся хрупкими, снижается содержание АТФ, и нарушаются окислительно—восстановительные процессы.
Марганец — распространенный в природе элемент, является постоянной составной частью живых организмов. В растениях содержание марганца колеблется от сотых до десятитысячных долей процента. Некоторые растения (ряска, чилим) способны накапливать значительные количества марганца. Этот элемент активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, биосинтеза нуклеиновых кислот Недостаток марганца вызывает некрозы — отмирание растительных тканей.
Кроме перечисленных, в состав растений входит ряд других микроэлементов. Некоторые из них способствуют росту или принимают участие в биохимических реакциях. Так, с окислительно—восстановительными процессами связаны: ванадий, никель, мышьяк. Ряд элементов принимает участие в ферментативных реакциях: кобальт, кадмий, литий. В состав растений также входят элементы биологическая роль, которых выяснена еще недостаточно.
Активная реакция
Жизнь гидробионтов в водной среде обитания существенно отличается от жизни живых существ в привычной нам воздушной среде. В водной среде обитания существуют такие лимитирующие экологические факторы, с которыми живые существа в воздушной среде не сталкиваются. Одним из них является активная реакция воды. В морской воде показатели этой реакции достаточно стабильны, в пресной - сильно варьируют в зависимости от сезона года и времени суток; они различны и в разных слоях воды.
Что же такое активная реакция воды?
Химическая формула воды, как известно, Н 2 О, ее молекула состоит из двух атомов водорода и одного кислорода. Часть молекул воды под влиянием слабого электричества распадается, на ионы; весь процесс называется диссоциацией. На такие же ионы распадаются соли, кислоты и щелочки, растворенные в воде. Ионы воды обозначаются Н + (свободные водородные ионы) и ОН - (гидроксильная группа ). Когда содержание и тех и других в воде равно, говорят, что вода имеет нейтральную реакцию. В такой воде диссоциирует одна молекула, на каждые 10000000, а эту цифру можно выразить как десять в седьмой степени 10 -7 (и тех и других ионов соответственно будет 10 -7 Н + Х 10 -7 ОН - = 10-14 ). В качестве показателя активной реакции воды будет десятичный логарифм показателя ионов с обратным знаком. Нейтральному показателю будет соответствовать (по иону водорода Н + ) цифра 7, называемая водородным показателем и обозначаемая латинскими буквами рН
Шкала показателей рН представляет собой прямую линию от 0 до 14, где уже известный нам показатель рН 7 находится строго посередине. Влево от него идут кислые воды (слабокислая - кислая - сильнокислая), вправо - щелочные (слабощелочная - щелочная - сильнощелочная). У морской воды рН 8,1 - 8,3; у пресной воды колебания сильнее, но вся шкала в биохимии все же не нужна. Жизнь в воде возможна в пределах рН 3,5 - 10,5. Иногда водные растения подщелачивают (из-за усиленного процесса фотосинтеза) поверхностные слои до рН 11, при этом подвижные гидробионты уходят в нижние слои воды, где этот показатель значительно ниже. Перемешивание слоев воды в природных водоемах (легкий ветерок даже в самых стоячих из них) сравнительно быстро уравнивает рН разных слоев. В аквариуме без вертикального вращения воды (от аэраторов и фильтра) от высокого показателя рН в верхних слоях может начаться разрушение тканей растений. Практически в большинстве случаев показатели рН колеблются в пределах 6,5 - 8,5; в давно не очищенных, загрязненных аквариумах у дна может быть и рН 5,4.
Показатель рН крайне подвижен, причем тем более, чем мягче вода. Он зависит от температуры воды, жизнедеятельности растений (следовательно, от освещения), степени подвижности воды в водоеме. В аквариуме этот показатель постоянно меняется, и судить о нем можно только приблизительно. В течение суток рН может колебаться 2 единицы и более, поэтому смешно читать в иных аквариумных пособиях: “Этим рыбам необходим рН 6,0 - 6,З - такую точность можно получить разве только в маленькой нерестовой банке без растений, но и в этом случае нельзя гарантировать, что показатель, замеренный, допустим, утром, сохранится в полдень, вечером и ночью. В аквариуме с водными растениями такая стабильность рН полностью исключена.
Последим, как меняется рН в аквариумной воде и течение суток. В процессе дыхания гидробионтов поглощается кислород, окисляются углеводы, выделяется углекислый газ и образуется энергия, используемая для жизнедеятельности. В химической формуле этот процесс будет выглядеть так: С 6 Н 12 О 6 + 6О 2 ® 6СО2 + 6Н 2 О + химическая энергия. Поступление в воду углекислого газа вызывает ее подкисление. Значит, все гидробионты своим дыханием способствуют снижению показателя рН. Особенно заметно это снижение ночью, когда растения не поглощают углекислоту. Днем, во время световой фазы фотосинтеза, активность потребления углекислоты растениями заметно возрастает. В химической формуле это выглядит так: 6СО 2 + 6Н 2 О + солнечная энергия ® С 6 Н 12 O6 + 6О 2 . Образуются углеводы и свободный кислород Поглощение СО 2 , растениями при хорошем освещении может идти столь активно, что поступление углекислоты, выдыхаемой теми же растениями и другими обитателями аквариума, не компенсирует потери, что вызывает повышение рН.
Значит, ночью рН в аквариуме перемещается по шкале показателей в кислую сторону, а днем - в щелочную. Компенсировать такие сдвиги рН можно двумя путями:
Устоявшуюся аквариумную воду опытные аквариумисты не меняют всю, а лишь регулярно подменивают ее часть. Вода, доливаемая взамен испарившейся, препятствует колебаниям рН, но имеет постоянную тенденцию к снижению этого показателя. Там, где вода достаточно жесткая, этой проблемы практически не существует.
-
Постоянно проводят аэрацию аквариума из пузырьков подаваемого в воду воздуха регулярно пополняется запас СО 2 и воде.
Особенно резко изменяются показатели рН в течение суток по слоям воды, если ее постоянно не перемешивать. В верхних слоях во время интенсивного фотосинтеза растений рН может подняться до 10 - 11, при этом у дна он сохранится стабильным (допустим, около 6,6), а в средних слоях будет колебаться от 6,5 (ночью) до 7 - 8 (днем). Суточные колебания рН в 1,5 - 2 единицы большинство гидробионтов еще могут выдержать, но колебания 6,5 - 11 днем для живого организма опасны. При рН 10 - 11 рыбы опускаются в нижние слои, а растения, породившие такое подщелачивание воды, начнут разрушаться в приповерхностных слоях.
Колебание показателя рН зависит и от температуры воды: с повышением температуры он снижается. Например, если замерять показатель при 0° С, нейтральной следует считать уже воду не с рН 7, а с рН 7,97 (почти 8), значит вода, имеющая рН 7 при 0° С, уже будет слабокислая.
В зависимости от отношения к концентрациям водородных и гидроксильных ионов все гидробионты подразделяются, на стеноионные (выдерживающие незначительные колебания) и эвриионные (способные переносить большие колебания). В гидробиологической литературе к первым относят тех, которые выдерживают колебания до 5 - 6 единиц. В аквариумной практике таких не так уж много, например, из растение - элодея, роголистник. Криптокорины, апоногетоны выдерживают плавные и регулярные колебания в 1 - 2 единицы, такие же колебания допустимы для большинства рыб, а виды, подобные дискусу, еще более стеноионны. Для обитателей аквариума существуют определение, так называемые рН - барьеры, выход за пределы которых как влево по шкале (в кислую сторону), так и вправо (в щелочную) недопустим. Недопустимо и перемещение обитателей аквариума из одной воды в другую при разнице их показателей рН больше чем на 0,8 - 1, так как могут возникнуть шок у рыб, быстрое или постепенное разрушение тканей растений.
Что же происходит с гидробионтами, когда показатель рН приближается к цифрам барьерами Изменения уловить трудно, но знать о них необходимо.
У растений наблюдается то явление, которое аквариумисты, не вдаваясь в его суть, назвали несовместимостью. Однако практически несовместимых растений в наших аквариумах нет, а есть ранения с разными рН-барьерами. Например, кабомба при повышении рН до 8 останавливает фотосинтетическую деятельность, валлиснерия продолжает ее до 10, а элодея и до 11. Ясно, что “голодающая” кабомба сначала остановит рост верхушечных стеблей, а затем будет сбрасывать листья. Постепенно и у валлиснерии начнут разрушаться концы листьев возле поверхности, степень подщелачивания верхних слоев воды элодеей для этих двух видов окажется непереносимым ежедневным испытанием. Более сложные растения потому и сложны в содержании, что у них нижний и верхний рН-барьеры незначительно отстоят друг от друга - ведь в текучих водах у них на родине нет таких скачков рН, какие происходят в аквариумах с неподвижной водой.
Снижение показателя рН воды повышает у рыб аппетит. Но радоваться этому не имеет смысла: аппетит вызван резким уменьшением усвояемости пищи, сокращением использования питательных веществ на рост, увеличением энергетических затрат. Некоторые рыбы (например, барбусы) начинают чесаться о грунт и камни, дискогнаты теряют ориентировку и гибнут, ряд сомов погибают от дистрофии при активном потреблении корма. Ухудшается у рыб и захват кровью кислорода, частота дыхания увеличивается, но появляются признаки удушья. Снижение показателя рН воды для многих тропических рыб служит стимулом к нересту - именно эти цифры и проставляют обычно для расбор, харацинид и других видов. Но держать их в подкисленной воде постоянно нецелесообразно, тем более выращивать молодь.
Наиболее подходящая вода для большинства обитателей аквариума должна иметь колебания рН около 7. Это достигаешься главным образом правильным уходом за аквариумом, регулярной сменой части воды, постоянным принудительным движением ее, чистотой водоема.
Редокс-потенциал водной среды
Жизнь в водной среде зависит не только от ее активной реакции (показатель рН), но и от окислительно-восстановительного потенциала, или редокс-потенциала. Редокс-потенциал стимулирует или тормозит рост и развитие водных организмов. Говоря о растворенных в воде газах, мы имеем в виду молекулярный кислород содержащий два атома этого газа (именно молекулярный кислород захватывается гемоглобином крови при дыхании животных, усваивается в процессе дыхания и выделяется в световой фазе фотосинтеза растениями), при изучении роли редокс-потенциала - атомарный кислород.
Слово редокс образовано от двух слов - редукция (восстановление) и оксидация (окисление). Редукцией будет процесс выделения кислорода или поглощения водорода, оксидацией - процесс поглощения кислорода.
Во время окислительных или восстановительных реакций изменяется электрический потенциал окисляемого или восстанавливаемого вещества: одно вещество, отдавая свои электроны и, заряжаясь положительно, окисляется, другое, приобретая электроны и заряжаясь отрицательно, - восстанавливается. Разность электрических потенциалов между ними и есть редокс-потенциал. При измерениях (в электрохимии) величина этой разности обозначается как Еh и выражается в милливольтах. Чем выше концентрация компонентов, способных к окислению, к концентрации компонентов, могущих восстанавливаться, тем выше показатель редокс-потенциала. Такие вещества, как кислород и хлор, стремятся к принятию электронов и имеют высокий электрический потенциал, следовательно окислителем может быть не только кислород, но и другие вещества (в частности, хлор), а вещества типа водорода, наоборот, охотно отдают электроны и имеют низкий электрический потенциал. Наибольшей окислительной способностью обладает кислород, а восстановительной - водород, но между ними располагаются и другие вещества, присутствующие в воде и менее интересно осуществляющие роль либо окислителей, либо восстановителей.
Таким образом, в водной среде постоянно происходят как окислительные, так и восстановительные реакции, не видимые глазу аквариумиста. В процессы окисления сразу после оборудования комнатного водоема включаются неорганические вещества. Заселение аквариума растениями и рыбами, другими животными усиливает окислительные процессы. В них включаются погибшие части корней и листьев, выделения животных, массовое появление, а затем гибель бактерий, поэтому в только что устроенном аквариуме высокий редокс-потенциал. Затем из круга окисляемых веществ выпадают в основном неорганические вещества - их доля в окислении в дальнейшем будет незначительна. Количество включаемых в процессы окисления органических веществ тоже стабилизируется (не отмирают поврежденные при посадке части растений стабилизируется постоянное количество бактерий в грунте и фильтре), и редокс-потенциал снижается. Он может, резко возрасти в результате экологической катастрофы, которую претерпевает среда обитания в аквариуме из-за неумелых действий любителя. К ним можно отнести резкую смену воды, слишком большую долю добавленной водопроводной воды, которая усиливает отмирание частей растений, вызывает массовую гибель бактерий. Резко повышает редокс-потенциал “цветение” воды. В целом показатель этого потенциала за годы существования аквариума имеет тенденцию к снижению - в старом аквариуме со “старой” водой и заиленным грунтом активнее протекают процессы восстановления.
В биохимии, в отличие от электрохимии, величины редокс-потенциала выражаются не в милливольтах, а в условных единицах гН (геduktiоn Нуdroqenii). Существуют специальные таблицы перевода результатов, измеренных с помощью прибора в милливольтах, в условные единицы гН. Шкала условных единиц содержит 42 деления, 0 означает чистый водород, 42 - чистый кислород. Естественно, что вблизи этих показателей жизнь невозможна. В пресных водоемах зона, пригодная для жизни, лежит между 25 и 35 единицами. В аквариуме она меньше - между 26 и 32 единицами. Некоторые растения выдерживают несколько меньший показатель rН (например, для криптокорины - 25,6), самый высокий уровень выдерживает гетерантера - 32.
Отношения рН и гН тесно взаимосвязаны. Окислительные процессы понижают показатель активной реакции воды (чем выше показатель гН, тем ниже рН), восстановительные - способствуют повышению рН. В свою очередь, показатель рН влияет, на величину гН. Так, бурный процесс фотосинтеза изменяет величину гН в зарослях таких растений, как злодея и кабомба, способных при фотосинтезе добывать СО 2 из бикарбонатов: в результате выделяется ион ОН - , подщелачивающий воду, и показатель гН снижается; при этом в других зонах аквариума он может оставаться неизменным. Следует отметить также, что величина гН в верхних слоях воды обычно выше, в нижних - ниже. Поскольку показатели рН колеблются в течение суток, и изменяется и величина гН. Она зависит также и от температуры воды.
Показатели редокс-потенциала измеряют сложными приборами с платиновыми электродами, пока недоступными аквариумистам. При этом определяются давление газа, концентрация восстановительной формы водорода.
Как же получить представление о величине редокс-потенциала, если определить ее практически нечем? Своеобразными индикаторами, позволяющими косвенно судить о показателях редокс-потенциала, служат растения. Так, разрастание сине-зеленых водорослей свидетельствует о высоком rН; высокий, хотя и несколько ниже, показатель гН способствует бурному росту зеленых водорослей. Большинство аквариумных цветковых растений развивается при 29 - 30 гН. Апоногетоны обильно цветут при 30,2 - 30,6 гН, а уже при 31 сбрасывают листья. При этом же показателе редокс-потенциала заболевают и останавливают рост эхинодорусы, в выше 31 апоногетоны и эхинодорусы теряют корневища. Криптокорины, наоборот, благоденствуют при гН 20 - 29, более высокий показатель ведет к их гибели, уже при 29 они перестают размножаться вегетативно.
Редокс-потенциал, как было сказано выше, более низок в придонных слоях воды. У поверхности грунта он больше, чем в самом грунте, если песок в аквариуме сильно слетался. По существу, именно грунт является “кухней погоды”, определяющей суммарный показатель редокс-потенциала в аквариуме: чем больше скапливается в грунте веществ имеющих тенденцию к отдаче электронов, тем более снижается гН. Для здоровья аквариума, продления благополучия видной среды необходимо поддерживать в нем чистоту, периодически промывать грунт.
Жесткость воды
Пресные воды сильно отличаются по жесткости. Этот показатель определяется присутствием в воде ионов кальция и магния, причем безразлично, в каких соединениях эти вещества находятся. Количество кальция и магния зависит от типа окружающих водоем почв, от площади водосбора, сезона, погоды, времени суток. Естественно, что вода, взятая из водоемов, в разных районах мира существенно отличается по жесткости. В прозрачной воде притока Амазонки Рио-Тапажос в одном литре содержится 1,48 мг ионов кальция, 0,1 2 - магния. В “черной” воде Рио-Негро - 1,88 мг кальция, а магния нет. В Амазонке после слияния основных притоков - соответственно 7,76 и 0,12. В Неве ионов кальция 3,0 мг, в Ниле - 15,8, .в Москве-реке - 61,5, в Волге у Саратова - 80,4 мг.
Ионы кальция и магния имеют знак “+” и обозначаются как Са ++ , Мg ++ ; они называются катионами и связаны с различными анионами, имеющими знак “-” .Если катионы связаны с анионами угольной кислоты, говорят о карбонатной жесткости воды, если с анионами хлора, соединений серы, азота, кремния, фосфора и т. д. - о некарбонатной жесткости. Сумма всех анионов определяет общую жесткость. Например, Рио-Тапажос. имеет общую жесткость 0,3 - 0,8, а карбонатную 0 - 0,3, Рио-Негро - 0,1 и 0 - 0,1, Амазонка - 0,6 - 1,2 и 0,2 - 0,4, Нева - 0,5 и 0,5, Москва-река - 4,2 и 4,1, Волга - 5,9 и 3,5.
Общая жесткость воды определяется постоянной и временной, или устранимой. Последнюю можно уменьшить, например кипячением воды; колеблется она и в зависимости от жизнедеятельности растений. С устранением временной жесткости снижается и общая жесткость воды. В гидрохимии жесткость воды выражается в миллиграмм-эквивалентах кальция и магния; 1 мг-экв. содержит 20,04 мг/л Са или 12,5 мг/л Мg. В биохимии этот показатель вырывается обычно в градусах. В советской аквариумной литературе принято выражать жесткость в немецких градусах dН (от слова немецкая жесткость - дойче Харте), но в книгах иных стран могут встретиться и другие градусы: один немецкий градус равен 0,36 мг-экв или 1,78° французского, 1,25° английского.
В жестких водах, содержащих соединения кальция, растения днем выделяют углекислый газ из карбонатных веществ. Происходит этот процесс в виде сложной химической реакции, в ходе которой образуется соль кальцин СаСО 3 , выпадающая в осадок игольчатыми кристалликами кальцита. Этот осадок покрывает серой пленкой листья тех растений, которых: “умеют” таким путем получать углекислый газ - элодеи, рдестов, кабомбы (не все аквариумные водные растении обладают такой способностью). Уменьшение количества карбонатов в воде ведет к снижению ее жесткости и называется биогенным умягчением воды. Оно тем выше, чем лучше освещены в аквариуме растения. Так как от карбонатной, временной, жесткости зависит общая, растения вызывают ее колебание в течение суток. При плохом освещении, а также ночью часть соли СаСО 3 вновь переходит в состояние ионного раствора. Следовательно, показатель жесткости столь же непостоянен, как и другие показатели воды. Особенно резко колеблется жесткость воды при ее “цветении”. Большие колебания временной и общей жесткости могут отрицательно сказаться, на здоровье обитателей аквариума.
В мягкой воде соль СаСО 3 вступает в реакцию с углекислым газом и существенно изменяет показатель рН. Углекислый газ, растворенный в воде, активно взаимодействует с водой, образуя угольную кислоту, а из нее получаются ионы бикарбоната, они диссоциируют и дают ионы карбоната, причем на всех этапах, этой сложной реакции вода обогащается ионами водорода. В жесткой воде кальций и магний выступают буфером, тормозящим эти сдвиги поэтому в городах, где водопроводная вода мягкая и временная, или карбонатная, жесткость невысока, ночью могут происходить заморы в аквариуме - гибель рыб и других, реагирующих на сдвиги рН животных. Часто криптокорины испытывают физиологический шок и сбрасывают листья. Там же, где вода имеет жесткость выше 6° dН, таких неприятностей можно не опасаться. По этой же причине криптокорины, лагенандры и ряд апоногетонов лучше культивировать в воде с жесткостью 6 - 8° dН, чем: в той воде, в которой они растут в природе (0,8 - 1,5° dН).
Водные растения, достаточно чувствительные к жесткости воды, предпочитают слабожесткую, хотя есть и исключения. Так, мадагаскарские апоногетоны решетчатые, баивианус растут в водах с жесткостью 0,8 - 1,2° dН, а в аквариумах погибают при жесткости 4 5°. Криптокорина цилиата, наоборот, растет при жесткости, превышающей 20 - 30°. В мягкой воде разрушаются раковины улиток, плохо переносят линьку креветки и раки - этим животным недостает кальция.
Углерод и его соединения
Углерод не только важнейший элемент питания растений в аквариуме, т.к. является основой для построения органических веществ, но и через свои соединения влияет на значения рН и жесткость воды.
Растения удовлетворяют свою потребность в углероде за счет свободного углекислого газа и в меньшей степени за счет угольной кислоты. Растворенный в воде углекислый газ большей частью остается в виде свободного СО 2 (99,3%) и в меньшей образует угольную кислоту. СО 2 поступает в воду аквариума за счет ее контакта с воздухом, выделяется при дыхании рыб, растений и других водных организмов, а также при разложении органических веществ (напр. листьев, остатков корма и т.д.). Он хорошо растворяется в воде, образуя при этом угольную кислоту (СО 2 +Н 2 <=> Н 2 СО 3 ), которая неустойчива и распадается, поэтому часть растворенного в воде СО 2 находится в свободном состоянии. Угольная кислота - слабая кислота и диссоциирует на ионы (Н 2 СО 3 <=> H+ + НСО 3- ), в результате концентрация ионов H + повышается и вода подкисляется. Таким образом, при повышении в воде содержания СО2 значение рН уменьшается.
Большинство растений в процессе фотосинтеза могут усваивать только свободный СО 2 , но некоторые из них при его нехватке приспособились использовать гидрокарбонаты кальция и магния, которые влияют на временную жесткость, и при их распаде происходит уменьшение ее значения, т.е. биогенное умягчение воды. В этом процессе одновременно протекают две реакции:
Са(НСО 3)2 = СО 2 + СаСО 3 + Н 2 O и Са(НСО 3)2 = 2СО 2 + Са(ОН)2.
Образующиеся в результате первой реакции карбонаты выпадают в осадок, образуя белый налет на листьях растений, во второй же реакции образуется щелочь, которая повышает значение рН, причем эта реакция идет тем интенсивнее и, следовательно, подщелачивание воды тем сильнее, чем выше значение КН.
Растениям безразлично, из какого содержания СО 2 в воде — 5 или 20 мг/л — они будут удовлетворять свою потребность, важно лишь, чтобы было постоянное и более или менее равномерное его поступление. Но 20 мг/л является почти предельной концентрацией, которая становится опасной для рыб.
В течение ночи, когда процесс фотосинтеза из-за отсутствия освещения не происходит, концентрация СО 2 вызванная дыханием рыб и растений, повышается и может стать опасной. Поэтому в это время важны аэрация и фильтрация, которые перемешивают слои воды, обогащая ее кислородом и удаляя углекислый газ.
В жесткой воде при значении рН близком к 8 количество углекислого газа недостаточно для большинства растений, и в этом случае нужно либо снизить содержание извести, т.е. понизить КН или, как показал опыт, еще лучше ввести в воду углекислый газ, что сдвинет значение рН в благоприятную для растений область.
К. Хорст приводит таблицу зависимости содержания СО 2 в воде от значений КН и рН и их влияние на рост растений (см. табл. 3).
Таблица 3
Содержание углекислого газа (мг/л) в воде
в зависимости от значений КН и pH и их влияние на рост растений
|
Много СO2 |
Оптимально
СО2
|
Мало
СO2Мало
СO2
|
||||||||
|
КН/pH |
6,0
|
6,2
|
6,4
|
6.6
|
6,8
|
7,0
|
7,2
|
7,4
|
7,6
|
7.8
|
|
0,5 |
15 |
9,3 |
5,9 |
3,7 |
2,4 |
1,5 |
0,93 |
0,59 |
0,37 |
0,24 |
|
1,0 |
30 |
18,6 |
11.8 |
7,4 |
4,7 |
3,0 |
1,86 |
1,18 ' |
0,74 |
0,47 |
|
1,5 |
44 |
28 |
17.6 |
11,1 |
7,0 |
4,4 |
2,8 |
1,76 |
1,11 |
0,7 |
|
2,0 |
59 |
37 |
24 |
14.8 |
9,4 |
5.9 |
3,7 |
2,4 |
1,48 |
0,94 |
|
2,5 |
73 |
46 |
30 |
18.5 |
11.8 |
7.3 |
4.6 |
3,0 |
1,85 |
1,18 |
|
3.0 |
87 |
56 |
35 |
22 |
14 |
8.7 |
5,6 |
3.5 |
2,2 |
1.4 |
|
3,5 |
103 |
65 |
41 |
26 |
16,4 |
10,3 |
6,5 |
4,1 |
2,6 |
1,64 |
|
4.0 |
118 |
75 |
47 |
30 |
18,7 |
11,8 |
7,5 |
4.7 |
3,0 |
1,87 |
|
5,0 |
147 |
93 |
59 |
37 |
23 |
14,7 |
9,3 |
5.9 |
3,7 |
2,3 |
|
6,0 |
177 |
112 |
71 |
45 |
28 |
17,7 |
11,2 |
7.1 |
4,5 |
2,8 |
|
8,0 |
240 |
149 |
94 |
59 |
37 |
24 |
14.9 |
9,4 |
5,9 |
3,7 |
|
10 |
300 |
186 |
118 |
74 |
47 |
30 |
18,6 |
11,8 |
7,4 |
4,7 |
|
15 |
440 |
280 |
176 |
111 |
70 |
44 |
28 |
17.6 |
11.1 |
7,0 |
|
20 |
590 |
370 |
240 |
148 |
94 |
59 |
37 |
24 |
14,8 |
9,4 |
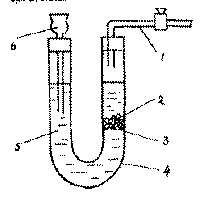
Рис. 1 Прибор для получения СО2:
1 - трубка с краном для выхода, 2 - известняк, 3 - перегородка, 4 - "V" образная трубка, 5 - соляная кислота, 6 - воронка.
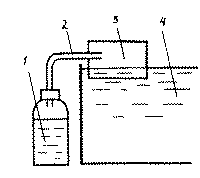
Рис. 2 Устройство для получения и подачи СО2
1 - сосуд с раствором сахара и дрожжами, 2 - трубка для подачи СО2, 3 - емкость, 4 - аквариум.
На рис. 1 показана схема прибора для получения СО 2 из известняковых пород. В одно из колен U-образной трубки (1) кладут перегородку из пластмассы или помещают шарик из полиэтиленовой пленки (2), а на него несколько кусочков мела (3). В другое колено наливают 10 - 15% раствор соляной кислоты (6) так, чтобы он покрыл известняк. Выделяющийся во время реакции СО 2 направляется по трубке (4) к аквариуму и подается в воду через распылитель. Если перекрыть вентилем подачу СО 2 то газ вытеснит кислоту из левого колена и реакция прекратится. Для определения концентрации СО 2 в воде аквариума производят измерения значений КН и рН и затем пользуются данными табл.
Другим способом получения СО 2 является метод брожения. Для этого стеклянный или пластмассовый сосуд объемом не менее 1 л заполняют смесью из 10% раствора сахара (100 г сахара на 1 л воды) и 2 г сухих дрожжей, затем его плотно закрывают и полученный в результате спиртового брожения СО 2 направляют по трубке в аквариум.
К. Паффрат рекомендует направлять газ в аквариум через специальную емкость, размер которой зависит от жесткости воды (рис.2). Емкость (3) представляет собой П-образную конструкцию высотой и шириной 3 см, а ее длина зависит от значения КН. Ее крепят к аквариуму, погрузив примерно на 1 см в воду.
За рубежом различные фирмы (например “Dupla”) предлагают комплекс, состоящий из баллона с СО 2 арматуры с манометрами, электромагнитного клапана и электронного измерителя рН, позволяющий поддерживать постоянным нужное значение рН.
Азот и его соединения
Азот — один из основных элементов, необходимых для животных и растений. Он входит в состав белков, являющихся частью растительных и животных клеток. Некоторые соединения азота в большой концентрации вредны для живых организмов, могут вызвать болезни и гибель рыб.
Азот образует простое вещество — газообразный азот, молекулы которого состоят из двух атомов N 2 . Этот газ без цвета и запаха является основным компонентом атмосферного .воздуха, где объемная доля N 2 равна 78%. Газообразный азот немного растворим в воде (в 100 г Н 2 О — 1,5 мл N 2 , при 20°С). Этот газ химически и биологически инертен: он практически не вступает в химические реакции ни на воздухе, ни в растворе и не играет существенной роли в химических и биохимических процессах, протекающих в аквариуме.
Следует обратить внимание аквариумистов на некоторые моменты кругооборота азота, происходящего в воде, поскольку, с одной стороны, соединения этого газа нужны растениям и другим гидробионтам, а с другой - могут оказать сильное токсическое воздействие, например аммоний и нитриты. Аммоний в аквариуме образуется в результате гниения органических остатков (корма, частей растений, трупов рыб), содержащих органические соединения азота. Собственно, процесс гниения и называется аммонификацией. В ходе этого процесса сложные азотсодержащие вещества превращаются в аммиак и воду, а аммиак может быть усвоен как минеральное вещество растениями. Впрочем, ряд авторов считают аммиак (NН 3 ) тоже токсичным, когда он скапливается в больших количествах. В литературе под аммонием (тоже минеральным веществом) понимают сумму ионов аммония (NН 3 ) и свободного аммиака.
Большинство рыб выделяет аммоний через жабры, на поверхности, которых происходит обмен его ионов на необходимые клеткам организма рыб ионы натрия.
Когда аквариум переселен, вода регулярно не подменивается, животные не могут избавиться от избытка аммония, который постоянно накапливается в организме в ходе азотного обмена. Ионы аммония и аммиака проникают в избытке через мембраны и вызывают отравление клеток, затем и всего организма. При высоком показателе рН более токсичен аммиак, следовательно, сдвига этого показателя в щелочную сторону допускать не следует. При низком содержании кислорода оба компонента аммония становятся еще более токсичными, значит, аэрация и фильтрация воды постоянно необходимы. Когда в перенаселенном аквариуме с несменяемой водой возрастает содержание аммония в результате обменных процессов и выделений, у рыб учащается дыхание даже при аэрации, но резко падает захват кровью молекул кислорода. А снижение кислорода в крови вызывает нарушение кислотно-щелочного баланса в организме.
Нитриты (NO3 ) также снижают способность гемоглобина крови захватывать и переносить кислород. Нитриты образуются в процессе окисления солей аммиака в соли азотной кислоты. Процесс заканчивается образованием нитратов (NO 3 ), а нитриты являются как бы промежуточным продуктом. Присутствие их даже в малых количествах в воде пресноводного аквариума достаточно опасно.
Нитраты не столь токсичны, но рыбы, живущие в воде с большой концентрацией этого соединения азота, постепенно приобретают бледную окраску жабр. Причины и следствия этого явления пока не установлены. Имеются данные, что длительное пребывание рыб в растворе с большой концентрацией нитратов вызывает нарушение координации движений, почесывание, снижение активности, затрудненное дыхание.
Для ослабления токсичности аммиака следует соблюдать четыре правила:
-
постоянная аэрация;
чистота в аквариуме;
регулярная подмена воды;
умеренное заселение растениями и животными.
Для ограничения содержания нитратов необходимы регулярная подмена воды и обязательное заселение растениями, причем излишки их нужно удалять.
Освоив содержание и разведение видов, нетребовательных к гидрохимическому составу воды, и перейдя к более капризным в этом отношении рыбам и растениям, аквариумист вынужден увеличивать или уменьшать жесткость воды, изменять активную реакцию рН. Особая необходимость в этом возникает при разведении рыб. Но бесконтрольное изменение водной среды “на глазок” не всегда эффективно, а в ряде случаен и опасно. В таких случаях знание методик измерения основных показателей воды (жесткости и рН) и умение их корректировать становятся необходимыми.


